 |
| Figura 1: Cinética Química |
A química está presente em cada detalhe do nosso cotidiano e o ramo responsável pelo estudo da velocidade das reações químicas e os fatores que as influenciam chama-se cinética química. Além disso, estuda também a possibilidade de controlar a taxa de rapidez tornando as reações mais rápidas ou mais lentas com base no mecanismo das reações. Pode se definir reações químicas como sendo um conjunto de fenômenos nos quais duas ou mais substâncias reagem entre si, dando origem a diferentes compostos. As reações podem ocorrer com velocidades diferentes, por exemplo, a decomposição do lixo é uma reação lenta que pode durar anos, diferentemente das reações de combustão que são rápidas. As velocidades podem ser alteradas sob influência de alguns fatores como:
 |
| Figura 2: Dissolvendo comprimido a) inteiro e b) em pó |
Superfície de Contato: quando a superfície de contato é aumentada a
velocidade da reação também irá aumentar. Isso pode ser observado em nosso
dia-a-dia, por exemplo, quando colocamos pra dissolver o comprimido, se
colocarmos inteiro ele leva um determinado tempo para se dissolver, mas quando
dividimos esse comprimido em duas ou mais partes é possível observar uma
mudança no tempo que ele leva para ser dissolvido, isso ocorre porque a superfície
de contato com a água é maior quando dividido.
A Pressão: Quando se
aumenta a pressão de um sistema gasoso, aumenta-se também a velocidade da
reação. Com a redução do volume de um recipiente para outro há o aumento da
pressão e esta faz com que as moléculas, agora em um espaço menor, se
choquem em uma menor de tempo, o que faz com que a velocidade da reação seja
maior.
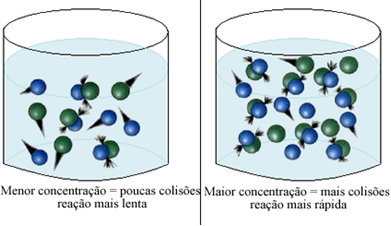 |
| Figura 3: Efeito da concentração |
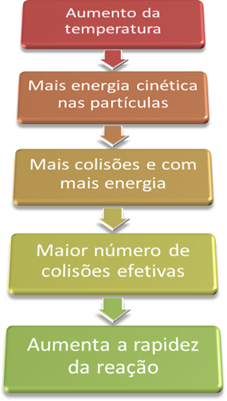 |
| Figura 4: Efeito da temperatura |
Por este motivo, aumentamos a chama do fogão para cozinhar ou congelamos os alimentos para evitar sua deterioração
Catalisadores: Os catalisadores são substâncias que aceleram as reações sem mudar
suas composições, durante as reações os catalisadores não são consumidos. Os
catalisadores alteram a energia de ativação das sustâncias, fazendo com que as
reações necessitem de menos energia para ocorrerem. Os catalisadores não
alteram o rendimento das reações, ou seja, eles produzem a mesma quantidade
de produto só que em um menor espaço de tempo. Temos como exemplo as enzimas,
que são catalisadores biológicos capazes de alterar a velocidade das reações em
nosso organismo como a amilase que é produzida pelo pâncreas e pelas
glândulas salivares, que atua na digestão do amido e do glicogênio contidos nos
alimentos.
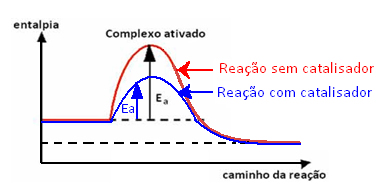 |
| Figura 5: Efeito do catalizador |
Referências
bibliográficas
ATKINS, P. JONES, L. Princípios de Química,
questionando a vida moderna e o meio ambiente, ... Rio de Janeiro: LTC-Livros Técnicos e Científicos,
1999
Figura 1:
Figura2:
http://www.brasilescola.com/upload/conteudo/images/b23303c04e003f443ad0adfc3a498423.jpg
Figura 3:
http://s1.static.brasilescola.com/img/2012/10/concentracao-dos-reagentes.jpg
Figura 4:
http://s3.static.brasilescola.com/img/2012/09/temperatura-na-velocidade-das-reacoes.jpg
Figura 5:
http://s1.static.brasilescola.com/img/2012/08/reacao-com-catalisador.jpg
Figura 1:
Figura2:
http://www.brasilescola.com/upload/conteudo/images/b23303c04e003f443ad0adfc3a498423.jpg
Figura 3:
http://s1.static.brasilescola.com/img/2012/10/concentracao-dos-reagentes.jpg
Figura 4:
http://s3.static.brasilescola.com/img/2012/09/temperatura-na-velocidade-das-reacoes.jpg
Figura 5:
http://s1.static.brasilescola.com/img/2012/08/reacao-com-catalisador.jpg


0 comentários:
Postar um comentário